| |
Дефекты в первичных ресничках приводят к серьезным заболеваниям в связи с их важной ролью в световой чувствительности и сигнальных путях во время развития. Однако многое неизвестно о структуре ресничек, механизмах их формирования и жизнедеятельности. Авторы используют крио электронную томографию, чтобы получить 3D карты соединительной пояска и прилегающих клеточных структур модифицированной первичной реснички, наружных сегментов палочек у мышей дикого типа и генетически дефектных. Результаты выявляют молекулярную архитектуру ресничек и проливают свет на функцию белков. По результатам предполагается, что цилиарный отросток вовлечен в клеточный транспорт и стабилизирует аксонему. Дефект в BBS белке оболочки мембраны вызывает дефекты в целевом транспорте везикул у основания реснички. Потеря белков, кодируемых геном Cngbl геном, разрушает связи между диском и плазматической мембраной. Структуры мембраны наружного сегмента поддерживают модель морфогенеза дисков, в которой базальные диски окружаются плазматической мембраной.
1А. Диаграмма палочки и области, прилежащей к соединительному пояску.
Введение
Первые этапы зрительного каскада при сумеречном освещении в сетчатке позвоночных происходят в наружном сегменте фоторецепторов (OS), модифицированной первичной ресничке. Наружный сегмент палочки грызунов содержит около 1000 пластинчатых мембранных дисков, содержащих родопсин и белки фототрансдукции. Диски постоянно слущиваются на дистальном конце наружного сегмента и фагоцитируются клетками пигментного эпителия (LaVail, 1976; Young, 1967). Они заменяются новыми дисками у основания наружного сегмента, что требует высокой скорости синтеза белков во внутреннем сегменте фоторецепторов, транспорте их из внутреннего сегмента в наружный через ресничную зону перехода, называемую соединяющим пояском (connecting cilium - CC). Основа соединяющего пояска заякорена в клетке полосатым отростком, который простирается на 50 мкм и дальше к синаптическому окончанию (Spira and Milman, 1979). Плохо определяемый матрикс белков, называемый перицентриолярным материалом и отросток обычно ассоциированы с ресничками и оба предполагаются как места целевого транспорта и доставки белков. (Kim et al., 2004; Yang and Li, 2005), но физических доказательств этого недостаточно.
Движение мембранных белков через соединяющий поясок считается опосредованным, хотя бы частично с помощью транспортного механизма, известного как интрафлагеллярный транспорт (IFT) (Kozminski et al., 1993; Pazouretal., 2002). Много мембранных белков обогащаются в фоторецепторах (Liu et al., 2007) и других чувствительных ресничках (Gherman et al., 2006; Mayer et al., 2009; Ostrowski et al., 2002), но найдено мало настоящих белков-мишеней интрафлагеллярного транспорта (Nachury et al., 2010). Многие растворимые белки также обогащаются в наружных сегментах. Хотя пассивная диффузия тоже жизненный способ транспорта растворимых белков через соединительную ресничку (Calvert et al ., 2010; Nair et al., 2005), существует несколько неизвестных цитоскелет-опосредованных механизмов прямого целевого транспорта растворимых белков через соединительный поясок (ресничку).
Эти механизмы, с помощью которых липиды и мембранные белки синтезируются во внутренних сегментах переносятся в наружный сегмент остаются противоречивыми, но известно, что включают перенос и слияние с пост-Гольджи пузырьками. В области соединительного пояска пузырьков не наблюдается, есть предположение, что транспорт везикул (пузырьков) сквозь соединительный поясок топологически невозможен (Jin et al., 2010). Другая модель предполагает, что родопсин-содержащие пузырьки продвигаются сквозь соединительный поясок для слияния с рождающимся мембранным диском наружного сегмента (Chuang et al., 2007), но есть мало прямых свидетельств пузырьков в соединительном пояске. В центре этого противоречия лежат дебаты 30-летней давности об инвагинационной природе возникновения дисков наружных сегментов фоторецепторов (Steinberg et al., 1980). Определение возможного механизма транспорта и биосинтеза дисков – критичный этап для понимания физиологии ресничек и заболеваний человека.
Цилиопатии сетчатки – генетические нарушения, вызывающие аномалии ресничек фоторецепторов и связанных с ними структур (Adams et al., 2007; Novarino et al., 2011) и фенотип варьирует от дегенерации сетчатки до плейотропных синдромов, таких как синдром Барде-Бидля (BBS). Недостаточность нескольких белков может приводить к синдрому Барде-Бидля, который является гетерогенным заболеванием, в том числе с признаками ожирения, полидактилией, пигментной абиотрофией сетчатки и задержкой умственного развития (Zaghloul and Katsanis, 2009). Мутации в белке BBS 4, как предполагается белок-переносчик в ресничках приводят к неправильному расположению белков наружного сегмента и приводят к гибели как палочек, так и колбочек (Abd-EI-Barr et al., 2007; Eichers et al., 2006; Swider-ski et al., 2007). Кроме того, функция наружного сегмента палочек зависит от цГМФ-зависимых каналов, расположенных в мембране, которые гиперполяризуют наружный сегмент в ответ на воздействие света. Палочко-специфичные изоформы 31 субъединицы канала, CNGB1a содержат уникальный домен, называемый белок, обогащенный остатками глутаминовой кислоты (glutamic acid rich protein - GARP) и его N конец, который также дополнительно экспрессируется как две растворимые изоформы GARP1 и GARP2 (Ardell et al., 2000; Korschen et al., 1995). Дегенерация сетчатки развивается при мутации в гене BBS4 и CNGB1, но структурно фенотипы мало отличаются друг от друга при электронной микроскопии. Такие цилиопатии имеют уникальные молекулярные характеристики, таким образом, ожидается, что структурные изменения в ресничках палочек содержат ключ к этиологии заболевания. Однако исходная структура и состав мутантных ресничек и ресничек дикого типа не до конца известны.
Большая часть наших знаний о ресничках получена из данных традиционной электронной микроскопии и определяется структурами, подвергающимися фиксации, окрашиванию, дегидратации, впечатыванию, которые повреждают мембраны и структуру клетки (Kellenberger et al., 1992). Вся структурная информация затем накладывается в одну проекцию по оси Z . Крио-электронная томография (cryo-ET) позволяет реконструировать 3 D структуру нефиксированных образцов, запечатленных в естественной жидкой среде (Yahav et al., 2011).
В статье представлены 3 D структуры
- ресничного пояска,
- базального тела,
- ресничного отростка и
-
наружного сегмента
палочек дикого типа, что выявляет новые структурные особенности, которые нелегко отметить на традиционной электронной микрофотографии. Авторы исследовали структурные изменения на мышах с недостатком рутлетина, главного компонента цилиарного отростка, CNGB 1 и обеих форм растворимых GARP BBS4. Томограммы мышей с этими наследственными нейродегенерациями сетчатки выявили структурные последствия, как прямые, так и непрямые, или особые молекулярные недостаточности.
Результаты
Подготовка наружных/внутренних сегментов фоторецепторов.
На рис 1А показана схематическая диаграмма структуры палочек с ее особенностями. Кругом обведена область клетки, которая смещена при перемешивании и потому изолирована изо-осмотической плотностью градиентного центрифугирования.
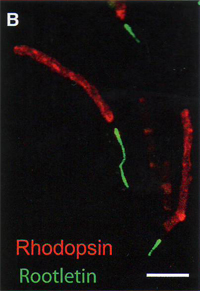
1 B. Иммунофлуоресценция изолированной палочки OS / IS препарата, окрашенной антителами, специфичными к родопсину (красный) и рутлетину (зеленый). 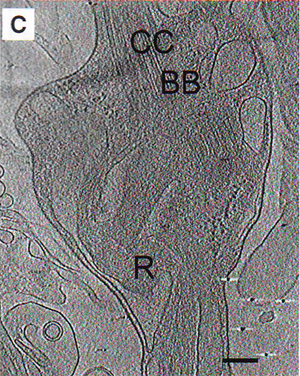
1С. Проекция (6 нм в толщину) из томограммы IS эллипсоидной области и прилежащие структуры соединительной реснички (СС), базальные тела ( BB ) и отросток ( rootlet – R ). 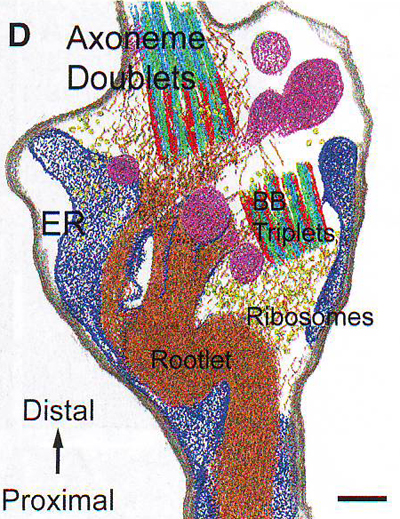
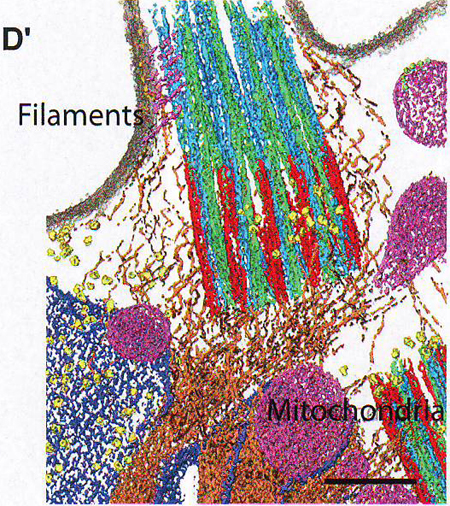
1 D. Сегментированная версия томограммы, показанной на рис. 1С. Микротрубочки (А-микротрубочки – голубой, B -микротрубочки – зеленый, С-микротрубочки – красный), филаменты аксонемы переходные волокна (розовый), отросток (коричневый), плазматическая мембрана (серый), эндоплазматический ретикулум (синий), митохондрии (фиолетовый), рибосомы (желтый).
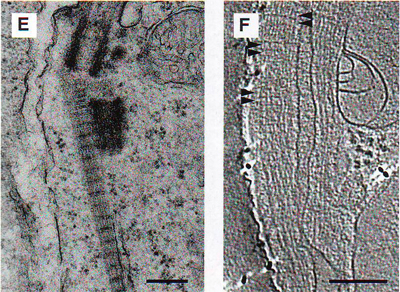
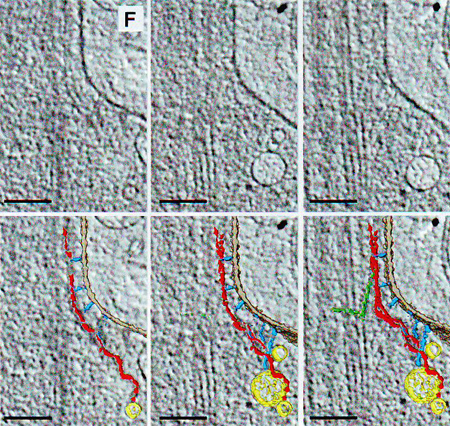
1Е. Стандартное изображение электронной микроскопии окрашенного ультратонкого среза сетчатки мыши, показывающее типичный полосатый цилиарный (ресничный) отросток, заканчивающийся рядом с проксимальным базальным телом. 1F . Проекция томограммы цилиарного отростка.
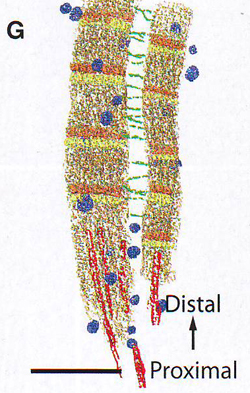
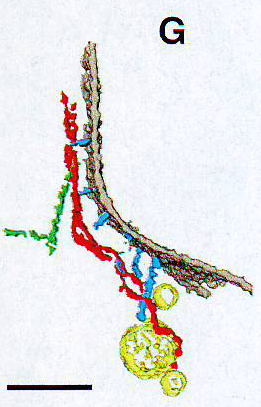
1G. Сегментированная версия рис. 1F, показывающая отросток, полоски, черные треугольные указатели на 1 F , оранжевые/желтые на 1G и 1I , филаменты (зеленым), и непузырьковые отросток-ассоциированные частицы (голубой). 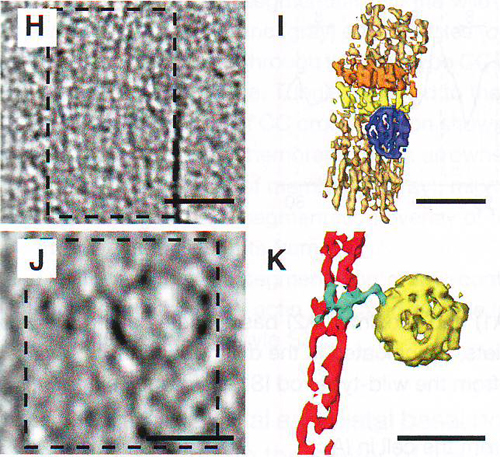
1H и 1I Увеличенная область томограммы с отросток-ассоциированной частицей, сегментировано на рис 1I. 1J и 1K. Томограмма и сегментация микротрубочки с прикрепленным пузырьком.
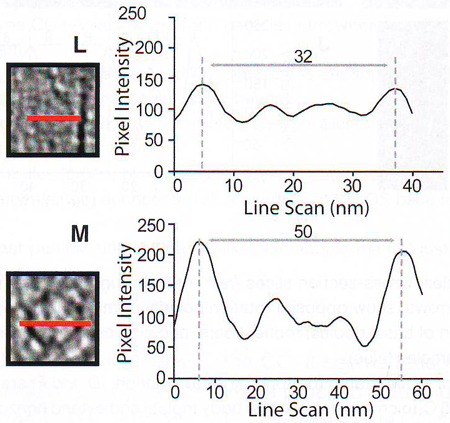
1L и 1M. Свойства аксиальной (осевой) плотности частиц (1 L ) и пузырьков (1 M ), взятых на 1 H и 1 J. 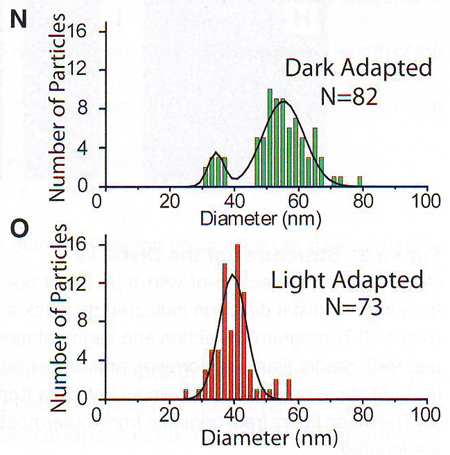
1N и 1O. Гистограммы диаметра остросток-ассоциированных частиц, измеренных в палочках от ( N ) темновой и (О) световой адаптированных сетчаток. N – общее количество частиц для каждого состояния.
Шкала: 1 B – 5 мкм, 1 C , D , F , G – 0,1 мкм, 1 E – 0,2 мкм, 1 H - K 50 нм.
Иммуноокрашивание фрагментов клеток, оцениваемое флуоресценцией (рис 1 B ) выявляет, что наружный сегмент, ярко окрашиваемый на родопсин, в большей степени интактен, тогда как внутренний сегмент, ярко окрашиваемый на рутлетин, основной компонент цилиарного отростка, раздроблен между эллипсоидной областью клетки (отдел внутреннего сегмента, прилежащий непосредственно к внешнему сегменту) и ядром.
Внутренний сегмент остается прикрепленным к внешнему сегменту с помощью соединительного пояска СС (также известного как зона перемещения), который не окрашивается ни одним из антител. Ясно показано, что родопсин синтезируется во внутреннем сегменте и переносится во внешний сегмент через соединительный поясок (см доказательства, приведенные ниже), но родопсин не накапливается в тех областях в достаточных количествах, чтобы быть найденным там с помощью иммунофлуоресценции. Из таких препаратов авторы приготовили 145 томограмм, 76 из них принадлежали мышам дикого типа. На рисунке 1С приведен 6 нм срез палочки, содержащий соединительный поясок СС, базальные тела BB и цилиарный отросток, сегментированную версию этой томограммы с общирной изоплотной поверхностью, окрашенной для наглядности, рис 1 D .
Приспособительные изменения в комплексе отростка светозависимы
Цилиарный отросток – самая большая структура во внутреннем сегменте и, как ранее показано, в основном состоит из волокнистого спирального белка рутлетина Yang et al., 2002). На некоторых томограммах ( 1 F , 1 G ) пары 20-нм исчерченностей четко прослеживаются на межпарных промежутках в 40 нм. Положение, исчерченность и размер отростка хорошо соотносятся с получаемыми снимками традиционной электронной микроскопии с тяжелыми металлами, как показано на 1Е. Свойства отростка показаны на рисунках 1 F и 1 I . Отросток может ветвиться, ветви соединены тонкими волокнами строго перпендикулярными продольной оси отростка (рис 1 F и 1 G ). На поверхности отростка, как украшения, могут отмечаться удлиненной эллипсоидной формы частицы (Рис. 1 G и 1 I .) Эти частицы легко отличить от пузырьков фосфолипидной мембраны (пример одного из них, прикрепленного к микротрубочке, можно увидеть на рис. 1 J и 1 K .) по своей уплощенной форме и низко контрастному краю (рис 1 L ), что резко отличается от четкой границы везикул, очерченных контрастом фосфолипидной головки по контуру (рис 1М). Предположив, что эти частицы могут принимать участие в транспорте, авторы исследовали количественное их содержание при темновой и световой адаптации фоторецепторов, так как известно, что транспорт веществ (уровень и направление) в одном и другом состоянии разительно отличается. При темновой адаптации частицы имеют бимодальное распределение с большим пиком 55 нм в диаметре и малым пиком 35 нм в диаметре (рис 1 N ), тогда как на свету наблюдался только 1 пик 40 нм (рис 1 O ). Эти наблюдения предполагают, что частицы и их взаимосвязь с отростком вовлечены в динамический адаптивный ответ палочек на освещенность.
Перицентриолярные структуры координируют органеллы и транспорт везикул
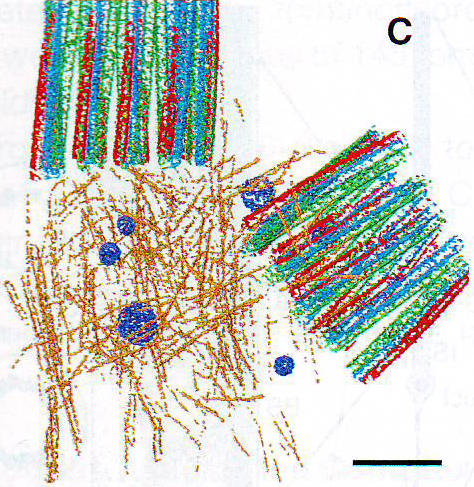
Когда изучают дистальные области внутреннего сегмента, выявляются дополнительные особенности (Рис. 1N и 1D), включая эндоплазматический ретикулум, обогащенный миоидными областями между ядром, эллипсоидным и митохондриями, как ранее известно, обогащенными эллипсоидом и рибосомами, определяемыми по их размеру, форме и высокой электронной плотности (из-за высокого содержания РНК). Некоторые из рибосом связаны с шероховатым эндоплазматическим ретикулумом. Наиболее легко узнающиеся органеллы в этой области внутреннего сегмента – это базальные тела (рис 1С и 1 D ) которые связаны короткими (300 нм в длину) кольцами девяти триплетов микротрубочек. Дистальное базальное тело, с которого начинаются дуплеты аксонемы цилиарного пояска, сидит на основании цилиарного пояска. Проксимальное базальное тело находится рядом с ориентированным строго перпендикулярно дистальным базальным телом. Однако наблюдается большой диапазон углов между осями двух базальных телец. Базальные тела совмещены с соответствующими краями, как видно при обратном направлении вращения триплетов, если смотреть вдоль наиболее длинной оси клетки (стрелки на рис 2А).
В этой области клетки множество филаментов, некоторые связаны с отростками базального тела, некоторые с другими органеллами (рис 1С) и некоторые с базальными телами плазматической мембраны (рис 2 D ). Эти последние филаменты могут являться сетью переходных волокон, видимых на традиционной картине электронной микроскопии (Deane et al., 2001). Также множество филаментов соединяются с дистальным и проксимальным базальными телами (рис 2 B и 2С). Волокно тянется к центру дистального (аксонемного) базального тела (рис 2 H ) и параллельно микротрубочкам. Эти волокна 7 нм в диаметре и 80 нм в длину и проявляют исчерченность через каждые 8 нм, определяемую расстоянием между димерами тубулина микротрубочек (рис 2 I , 2 J ), хотя у волокна нет правильного размера, ожидаемого у микротрубочек.
Многие пузырьковые и непузырьковые карго сливаются на цилиарном пояске в перицентриолярный материал до того, как достигнуть наружного сегмента. Каждая томограмма с хорошим контрастом в этой дистальной области внутреннего сегмента содержит множество пузырьков. Малый размер этих пузырьков в пределах от 30 до 100 нм в диаметре затрудняет их обнаружение на ультратонких срезах. Всегда эти везикулы связаны с филаментами, прикрепленными к плазматической мембране, базальным телам, отростку или соединительному пояску (рис 2 D – 2 F ) Из-за большого количества мембранного материала перенос от пост-Гольджи пузырьков в наружный сегмент через соединительный поясок представляется разумным предположить, что эти пузырьки в процессе слияния с плазматической мембраной дистального внутреннего сегмента по пути к соединительному пояску для интрафлагеллярного транспорта или другим механизмам.
Структуры соединительного пояска компартментализованны
У основания соединительного пояска триплет микротрубочек базального тела (рис 1, 2) переходит в дуплет, которые продолжаются в виде 9+0 аксонемных связок сквозь всю зону перехода и внутри наружного сегмента (рис 3). Дистальные присоединения и переходные волокна расширяются от С-микротрубочек к плазматической мембране (Рис 2D-2G). Просвет аксонемы не пустой и содержит множество частиц, состоящих, по всей видимости, из белка (Рис 3А – 3 F ). Хотя не наблюдается структур, напоминающих фосфолипидные пузырьки, в просвете акссонемы, некоторые срезы содержат объекты, чья плотность соответствует пузырькам диаметром 30 нм, расположенных в пространстве между аксонемой и плазматической мембраной соединительного пояска (ис 3 F ).
Трубочкоподобные структуры идут параллельно длине аксонемы между микротрубочкой и плазматической мембраной и появляются связи с микротрубочками (рис 3 D – 3 F ). Они соединены с микротрубочками дополнительными филаментами, лежащими между двумя структурами (зеленым рис 2 F – 2 G ). На дистальном конце соединительного пояска находятся плотные пучки филаментов, тянущиеся в проксимальный наружный сегмент и соединяющиеся с краями базальных дисков (рис 3 G – 3 I ). Эти филаменты по размеру сходны с актиновыми, окрашивание которого в этой области описано ранее в работах по иммуноокрашиванию в электронной микроскопии (Chaitin, 1989; Chaitin, 1992; Chaitin and Bok, 1986; Chaitin et al., 1984) и с помощью флуоресцентной метки (Del Prioreetal., 1987). Также в этой области в просвете есть филаменты, прикрепляющиеся к частицам с низкой оптической плотности в области соединительного пояска с микротрубочками аксонемы (рис 3 J - 3 K ).
Плазматическая мембрана соединительного пояска не гладкая, на ней много выпячиваний, которые соотвествуют описанным ранее «цилиарным ожерельям» (рис 4). Плазматическая мембрана соединительного пояска содержит довольно много родопсина (рис 4С, 4 D ) и, как выявлено с помощью ферритин-меченного конканавалина А, лектин, который связывается с маннозильными остатками родопсина (Renthal et al., 1973). Авторы проанализировали поверхностное распределение частиц ферритина на соединительном пояске и нашли корреляцию с распределением Пуассона (рис 4Е). Эта находка оспаривает предположение о том, что кластеры родопсина транспортируются на липидных плотах, ассоциированных с частицами интрафлагеллярного транспорта.
Все мембраны дисков окружаются плазматической мембраной
У основания наружного сегмента зарождаются диски, которые намного меньше, чем диски находящиеся в дистальном направлении (рис 5 B , 5 C ). Они окружены интактной плазматической мембраной и нет очевидного продолжения между мембранами базальных дисков и плазматической мембраной (стрелки на рис 5 B ). Хотя опубликовано много традиционных электронных микрофотографий, в которых просвет базальных дисков кажется открытым в межклеточное пространство, которое авторы также наблюдали на некоторых своих срезах, также авторы нашли несколько срезов окрашенных секций, которые состоят из плазматической мембраны, обволакивающей базальные диски (стрелка на рис. 5С) и в некоторых ранее опубликованных работах (Chuang et al., 2007; Sigelman и Ozanics, 1982).
Некоторый объем среза размыт, так как не хватает клина, это проблема электронной микрофотографии, авторы не могут выявить, есть ли небольшие области продолжения плазматической мембраны и мембраны диска. В меченных ферритином-конканавалином А палочках с интактными мембранами авторы не наблюдали ферритиновую метку в просвете диска, что показывает, что любое открытие внеклеточному пространству нелегко трансформируется в объекты размером с рассматриваемые комплексы. Хотя однозначно сказать все же нельзя, эти результаты ставят под сомнение широко распространенную модель образования мембранных дисков, в которой предполагается образование дисков путем инвагинации плазматической мембраны, оставляя внутреннее содержимое диска открытым внеклеточной среде.
Диски представляются намного более правильными в пространствах между ними на томограммах, нежели на традиционных снимках электронной микроскопии (рис 5). Трансформация Фурье среза стопки дисков содержит несколько ярких пятен, отвечающих повторяющимся единицам дисковых стопок (5 D , 5 G ) с расстоянием между дисками 32 нм, также подтвержденным прямым измерением и даже с визуализацией димеров тубулина каждые 8 нм. Таким образом, микротрубочки более вероятно, чем междисковые спейсеры, регулируют это расстояние. Количественный подсчет стопок дисков и их пространственное взаиморасположение с плазматической мембраной и аксонемой представлено на рис. 6.
Нокаутные модели дегенерации сетчатки
Чтобы проиллюстрировать способность крио электронной томографии выявлять структурные дефекты, встречающиеся при болезни, авторы выбрали три мышиные модели:
- Crocc -/- нокаутные по гену рутлетина, где основной дефект наблюдается в структуре внутреннего сегмента,
- Bbs 4 -/- нокаутные мыши, с основным дефектом в BBS оме, белковом транспортном комплексе от или к соединительному пояску (Jin and Nachury, 2009; Jin et all, 2010),
- Cngb 1 -/- нокаутные мыши с основным дефектом структуры наружного сегмента.
Каждая модель представляет пример четко известного структурного дефекта вследствие потери функции нехватающего белка.
Отросток стабилизирует аксонему пояска
Нокаут гена Crocc, кодирующего рутлетин, приводит к полному отсутствию отростка, который является самым большоей и наиболее очевидной структурой внутреннего сегмента (рис 7). Предполагается, что отросток играет роль в расположении органелл клетки и структурной стабильности соединительного пояска (Yang et al., 2005). Некоторые срезы мышей дикого типа содержат митохондрии, заякоренные в отростке. (рис 1С, фиолетовый), что полностью отсутствует в нокаутных мышах. Показано, что отросток важен для стабильности фоторецепторов, потому что недостаток рутлетина приводит к прогрессивной потере фоторецепторов (Yang et al., 2005). По сравнению с диким типом у Crocc нокаутных мышей наблюдается в пять раз чаще надлом в области соединительного пояска, хрупкость аксонемы, что предполагает важность рутлетина в физической стабильности диаметра соединительного пояска. Аксиальное соотношение ( Y : X сравнение ширины), взятое из аксонемных микротрубочек показывает, что реснички без рутлетина не достаточно цельны и более сдавлены на реконструированных томограммах (рис 7Е и 7 F ), чем реснички дикого типа. Эти данные получены из множества срезов для каждого генотипа мышей различных возрастов (от 3 недель до 18 месяцев) при предположении, что возраст мыши и способ подготовки среза влияет на получаемые различия.
Даже в отсутствии рутлетина базальные тела правильно расположены и связаны с множеством соединительных волокон диаметром 5 нм (Kobayashi и Dynlacht, 2011) (Рис 7C ). В малом количестве рутлетин-недостаточных палочек электронно плотные, но плохо организованные кристаллоидные гранулы наблюдаются во внутреннем сегменте вокруг базальных телец. Хотя молекулярная идентификация и значимость этих гранул неизвестна, они могут показывать стрессовый ответ этих палочек, который отсутствует в фоторецепторах дикого типа.
Потеря BBS4 приводит к повреждению распределения пузырьков
BBS – плейотропная цилиопатия, ассоциированная с пигментной абиотрофией сетчатки, которая приводит к дегенерации обоих видов фоторецепторов (палочек и колбочек) Adams et al., 2007). Октамерный комплекс BBS связанных белков, называемый BBS омой, вовлечен в транспорт белков большей частью в области соединительного пояска путем формирования мембранной оболочки, необходимой для сортировки белков (Jin et al., 2010). Томограммы из изолированных Bbs -/- палочек выявляют диски параллельно (Рис 7 G ), а не перпендикулярно (рис 5А и 5 B ) аксонеме, показатель аномального морфогенеза наружного сегмента (Swiderski et al., 2007). Аберрантная морфология наружного сегмента может приводить к дефектам транспорта белка и мембран через СО. В поддержку этой гипотезы наблюдают накопление множества пузырьков размером 35 нм вдоль аксонемы, базального тельца, и внутренней поверхности мембраны внутреннего сегмента у Bbs -/- палочек (рис 7 H и 7 I ). Это могут быть пост-Гольджи пузырьки, предназначенные для наружного сегмента, которые не в состоянии слиться с наружной мембраной или не могут быть перенесены через СО вследствие дефекта BBS омы. Пузырьки отсутствуют в большинстве срезов дикого типа (рис 3 F ) вероятно вследствие быстрого смешения и транспорта, препятствующего их накоплению в СО. В Bbs -/- мышах наблюдается накопление пузырьков вдоль стенок мембраны и неправильная локализация пигментов колбочек и родопсина (Abd-EI-Barr et al., 2007).
Потеря Cngb1a и GARP приводит к неконтролируемому росту диска, однако расстояние между дисками сохраняется правильным
Свет вызывает гиперполяризацию наружного сегмента путем закрытия цГМФ-зависимых катионных каналов в плазматической мембране наружного сегмента фоторецептора. GARP домен, кодируемый геном циклического нуклеотидного канала субъединица 1а ( CNGB 1 a ) может играть структурную роль. (Ardell et al., 2000; Korschen et al., 1995). Дикий тип наружного сегмента палочек содержит сотни дисков с расстоянием между дисками 32 нм (рис 6 B ) по всей длине наружного сегмента (рис 5А). Белок тетраспанин, периферин-2 и rom -1, присутствующие в просвете диска могут формировать межмембранные комплексы с каналом CNGB плазматической мембраны. Это взаимодействие, как считается, вовлекает N - онец GARP и возможно растворимого GARP 2 (Poetsch et al., 2001).
Недавнее обнаружение больших спейсеров на томограммах наружного сегмента привело к предположению, что точное расстояние между дисками регулируется растворимыми GARP ами. (Nickell et al., 2007). (Zhang et al., 2009) провели крио электронные срезы палочек с недостатком CNGB 1 и его GARP домена, а также обоих GARP и сравнили томограммы с диким типом наружных сегментов. Компьютерное распределение паттернов изображений дикого типа наружных сегментов с высоким разрешением более 5 нм с реконструкцией 1,7 нм на пиксель показало четкое пространственное распределение дисков (рис 5 F , 5 G , 6 B ). В отличие от дикого типа, Cngb 1 -/- палочки были серьезно повреждены во время подготовки образца (рис 7 J и 7 K ). Абнормальный размер дисков – один из признаков Cngb 1 -/- палочек (Zhang et al., 2009). Схожим с описанными в литературе данными авторы обнаружили разрушенные наружные сегменты с диаметром 5-6 мкм в мутантных палочках. У этих мутантов мембраны дисков сохраняют связь с аксонемой (рис 7 J и 7 K ), что является нормальным. Это наблюдение предполагает, что абнормальный диаметр наружного сегмента проявляется в результате потери диском связи со щелью плазматической мембраны через канал и/или GARP . Подтверждая эту гипотезу, наблюдаемые мембранные диски выпячивались из наружного сегмента, изгибаясь и возвращаясь обратно в наружный сегмент Cngb 1 -/- палочек (рис 7 L ). Паттерны распределения мутантных дисков показывают, что расстояние между дисками не нарушено как в свето-адаптированной, так и в темно-адаптированной сетчатке (рис 7М). Эти находки предполагают, что контакт между щелями дисков и плазматической мембраной, опосредованный CNG канальным комплексом, необходим для поддержания точного диаметра диска, и что растворимые GARP субъединицы не играют значительной структурной роли в поддержании постоянным расстояния между дисками или прикрепления дисков к аксонеме.
Обсуждение
Исследования (Nicastro et al., 2006) показали, что крио ЕТ – мощный инструмент в изучении пространственной структуры эукариотической аксонемы. 3 D реконструкции авторов во льду выявили несколько неожиданных свойств относительно роли генетических мутаций в развитии заболевания. Приведены количественные характеристики соединительного пояска (рис 6), что раньше было затруднительным сделать вследствие сдвигов при подготовке образца. Некоторые свойства характеры для всех ресничек, некоторые только для фоторецепторов.
Структуры отростка были определены в сравнении с различными эукариотическими ресничками, репродуктивная ткань ( Anderson , 1972), дыхательный эпителий ( Yang et al ., 2005), и стереоцилии волосковых клеток ( Kitajiri et al ., 2010). Хотя отростки находят во многих типах клеток, не ясно, присутствует ли рутлетин во всех из них, или только в случае исчерченности. Транспорт вдоль отростка ранее не был описан, однако авторы обнаружили светорегулируемые изменения в динамике невезикулярных карго вдоль отростка. Волокна, связывают отросток с базальными телами, однако отсутствие рутлетина не влияет на положение базальных телец или утолщение структуры аксонемы. Хрупкость наблюдается в удаленных от отростка участках рутлетин-дефицитных палочек, предполагая непрямую роль в снабжении компонентами, необходимыми для стабильности. В этой связи светозависимый динамизм отросток-ассоциированных частиц предполагает возможную роль в транспорте этих компонентов. Факт, что рутлетин широко экспрессируется в тканях млекопитающих предполагает, что рутлетин может быть важным также для функционирования нефоторецепторных ресничек.
Изученные авторами параметры позволяют взглянуть на организацию прецилиарного региона, окружающего соединяющий поясок и выявить сложность организации структур этой области. В дистальном внутреннем сегменте, прилежащем к соединительному пояску находится плотная сеть переместительных волокон, волокон отростка и дистальных отростков, ассоциированных с базальными тельцами, транспортными везикулами и перицилиарной плазматической мембраной. Перенос волокон от базальных телец С-микротрубочек ориентирован перпендикулярно аксонеме и заякоривает аксонему в плазматической мембране. Авторы наблюдали дополнительные волокна, начинающиеся в отростке и внутреннем сегменте, которые формируют трубчатые структуры параллельно аксонеме (рис 2 и 3). Эти структуры ассоциированы с пузырьками и играют роль в сортировке и транспорте через соединительный поясок. Многие белки, связанные с интрафлагеллярным транспортом, находятся в этой области (Sedmak and Wolfrum, 2010), и, вероятно, филаменты играют роль в организации частиц для этого транспорта. Дефекты белков, расположенных в цилиарной мембране, в том числе и интрафлагеллярные белки, также проявляются цилиопатиями сетчатки. Мутации в комплексах сетей структурных и сигнальных белков приводят к фенотипу глухоты и слепоты (синдром Ашера/Ушера Maerker et al., 2008). Эта сигнальная сеть расположена перицилиарно (Yang et al., 2010) мембранному комплексу, структуре в апикальном внутреннем сегменте, прилежащем к соединительному пояску, который соответствует перицилиарной области на томограмме. Этот комплекс важен для заякоривания родопсин-транспортных пузырьков для транспорта через соединительный поясок.
Наблюдение пузырьков в соединительном пояске и филамент-ассоциированных частицах в просвете аксонемы предполагает разные способы транспорта в дополнение к интрафлагеллярному для обновления наружных сегментов.
Актиновые филаменты вовлечены в сортировку молекул между плазматической мембраной и дисками. Дефекты в этих структурах и их ассоциированные функции могут быть механизмами, по которым цилиарные дефекты приводят к заболеваниям человека. Некоторые из этих дефектов могут быть специфичны для фоторецепторов, однако могут наблюдаться и цилиопатии с вовлечением различных органов, как при синдроме Барде-Бидля.
BBS омный комплекс, формирующий мембранную оболочку, по предположениям играет роль в накоплении пузырьков на мембране ресничек (Jin et al., 2010). Данные авторов подтверждает, что идет активное накопление пузырьков вдоль мембраны клетки.
Стандартная модель формирования мембранных пузырьков, описанная Chuang et al., 2007 очень противоречива. В работе авторов четко показаны данные о морфологии формирования новых дисков. По теории авторов родопсин и другие мембранные белки соединительного пояска транспортируются из плазматической мембраны клетки, поэтому должны быть механизмы (возможно, опосредованные актиновыми филаментами) по перемещению этих белков в зарождающиеся мембранные диски.
Авторы показали роль GARP в формировании расстояния между дисками, показав, что в отсутствие GARP расстояние не меняется, хотя форма диска значительно деформируется. Эти данные были получены путем прямого измерения и количественного анализа распределения Фурье. Было посчитано расстояние между дисками – 32 нм, разделенное тубулиновыми димерами по 8 нм. Эта модель может быть удобной для изучения цилиопатий.
Эксперименты
Мыши C57BI/6 и мыши с цилиопатией. Иммуноокрашивание и northern blotting. Изоляция наружных сегментов.

2А. Проекция томограммы базальных телец дикого типа. Поперечные срезы (красные линии) через дистальное (А1) и проксимальное (А2) базальное тельце вдоль оси z (направление от проксимального к дистальному, показанное черными стрелками) показывает обратную полярность вращения триплетов микротрубочек, как показано на диаграмме справа. 
2 B и 2С. Проекция томограммы и сегментация базальных телец, волокон отростка и непузырьковых частиц из палочки дикого типа IS . Микротрубочки (зеленые, голубые и красные), филаменты отростка (коричневый) и частицы отростка (голубой).

2D, E, F. Различные проекции, показанные в виде исходных данных (сверху) и аннотированных сегментаций (снизу). Рис D и F из клетки на рисунке А. 2D. Переходные волокна (красный) происходят из наиболее удаленных С-микротрубочек триплетов базального тела продолжаются горизонтально к плазматической мембране, где расположены пузырьки (желтые). 2E. Пузырьки (желтые) привязаны к плазматической мембране волокнами белков (синий).
2F. Три последовательных среза томографии. Из С-микротрубочки продлеваются дистальные придатки (зеленые), которые продлеваются как радиально к соседним микротрубочкам, так и дистально в ресничку. Филаменты происходят из внутреннего сегмента (IS, красным), взаимодействуют с пузырьками (желтый), с дистальными придатками С-микротрубочек (зеленые) и филаментами цилиарной мембраны.
2G. Сегментация пузырьков (желтый) из F, филаменты внутреннего сегмента ( IS ), дистальные придатки (зеленый) и соединения мембраны (синий) в перицентриолярной области.

2H. Проекция томограммы сквозь базальное тело аксонемы, показывающая филаменты отростка 80 нм в длину (черный квадрат), расширяющийся в центр аксонемы. 2I. Увеличение ограниченной области из рисунка 2 H показывает различные плотности филаментов.
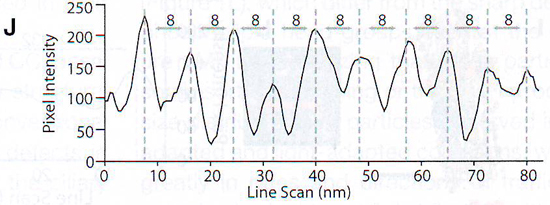
2J. Профиль плотности филамента (показан красной линией на 2I ). Шкала: 0,1 мкм.
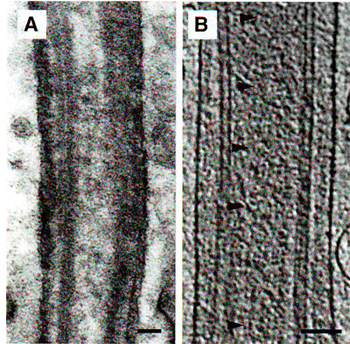
3А. Традиционное изображение электронной микроскопии соединительной реснички из окрашенных палочек. Шкала 0,1 мкм.
3 B, C. Томограмма и сегментация соединительной реснички дикого типа выявляет низкоконтрастные частицы (головки стрелок на 3В), связанные с микротрубочками в отделе центральной аксонемы. Мембрана соединительной реснички (СС) серый и частицы (зеленый). 3D. Проекции томограммы через соединительную ресничку дикого типа в плоскости X - Y (сверху) и X - Z плоскости поперечного среза (внизу) выявляет трубочки 20 нм, удлиняющие соединительные реснички, параллельно аксонеме. Трубочка ограничена внешним аксонемным пространством (головки стрелок).
3E. Проекция томограммы поперечного среза соединительной реснички, показывающая трубочки 20 нм (белые стрелки) параллельно микротрубочкам аксонемы. Один пузырек показан между аксонемой и плазматической мембраной (черная стрелка). 3F. Сегментация из рис. 3Е. мембраны (серый), микротрубочек (зеленый, голубой), частиц (зеленый), трубочек (красный) и пузырьков (желтый) в диком типе соединительной реснички.

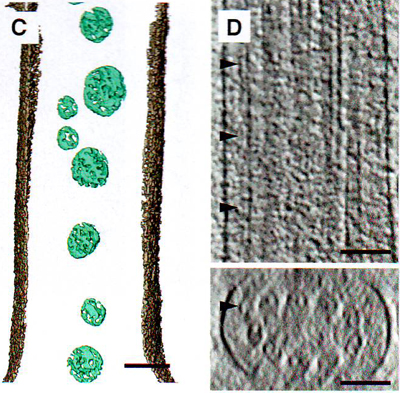
3G и 3H. Томограмма и наложение сегментации филаментов (красный), заякоривающих дисковую щель (белый), у основания наружного сегмента ( OS ) к аксонемной микротрубочке соединительной реснички (СС).

3I . Сегментация филамента из рисунка 3B.
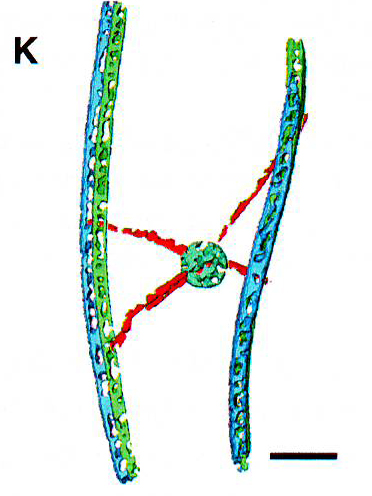
3J и 3K. Томограмма и сегментация малоконтрастных частиц, связанных с актиноподобными филаментами в соединительной ресничке непосредственно под областью появляющегося диска наружного сегмента. Микротрубочки (зеленые, синие), актин (красный), частицы (зеленый).
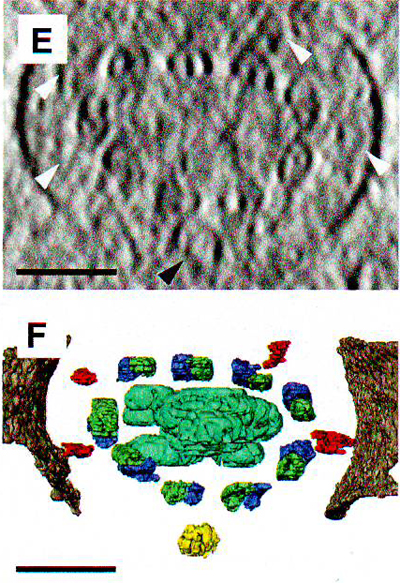
Рис. 4. Структуры, ассоциированные с ресничной мембраной. 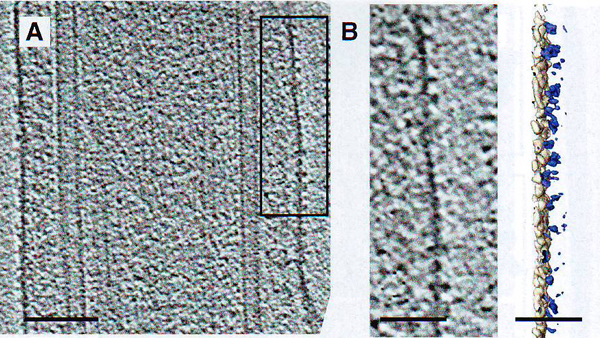
4А. Плотность белка в мембране соединительной реснички. 4B. Томограмма и сегментация мембранных уплотнений (рамка на рисунке А), мембрана (серый) и белки (синие).
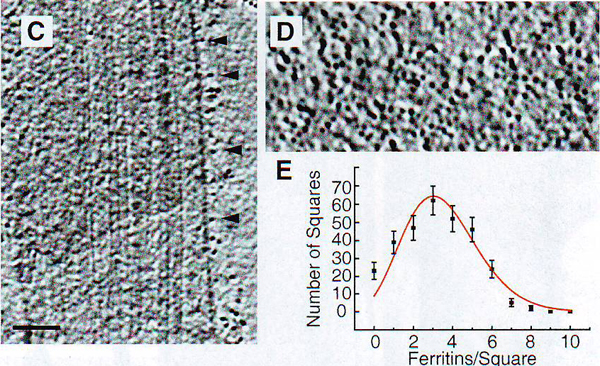
4С. Конканавалин А-ферритиновые метки N -концов родопсина в проекции томограммы через соединительную ресничку. Стержневидные выпячивания, видимые на А и B , мечены ферритином (стрелки). 4D. Томограмма поверхности мембраны соединительной реснички (СС) с родопсином, меченным конканавалин А-ферритином. 4Е. Гистограмма распределения родоспин-ферритин внутри цилиарной мембраны. Область площадью 0,27 мкм 2 была разделена на 300 равных квадратов и было подсчитано количество ферритинов в каждом (всего 952). Кривая – ожидаемое случайное распределение (Clarke, 1946). Шкала А и С 0,1 мкм. В 50 нм.
Рис. 5. Структуры наружного сегмента. 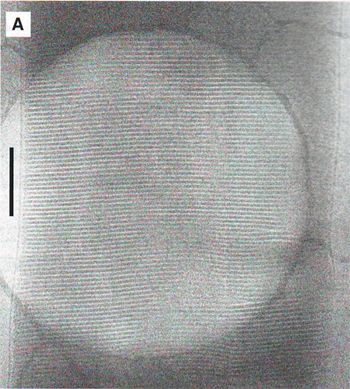
5А. Микрографии застеклованной палочки (наружного сегмента, OS), показывающего расположение 32 дисков на мкм.

5B. Крио электронная томография сохраняет исходную структурную организацию палочкового наружного сегмента. Рождающийся диск внутри плазматической мембраны наружного сегмента палочки (стрелки).
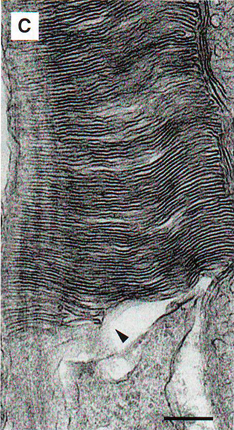
5C. Традиционная микрография окрашенной палочки, показывающей рождение дисков, содержащихся в плазматической мембране наружного сегмента (стрелки).

5D, 5E. Томограмма и сегментация стопки дисков палочки дикого типа

5F. Трансформация Фурье (компьютеризированный паттерн дифракции) из области, показанной пунктиром на рис. 5 D показывает до 6 максимумов интенсивности в реципрокном пространстве (наверху). Анализ, проведенный на томограмме с разрешением 1,7 нм/точку. Максимально полученное разрешение (1/5.05 нм) отвечает толщине двойного слоя диска наружного сегмента (внизу).
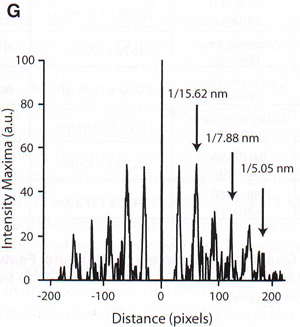
5G. Частота спектров максимума на (F) подтверждает 6 скрытых пиков, присутствующих в представленных данных. Шкала: 5А 0,5 мкм, 5 B 0,2 мкм, 5С 0,4 мкм, 5 D 0,1 мкм. 5 F 15 нм.
Рис. 6. Количественный подсчет структурных свойств реснички фоторецептора 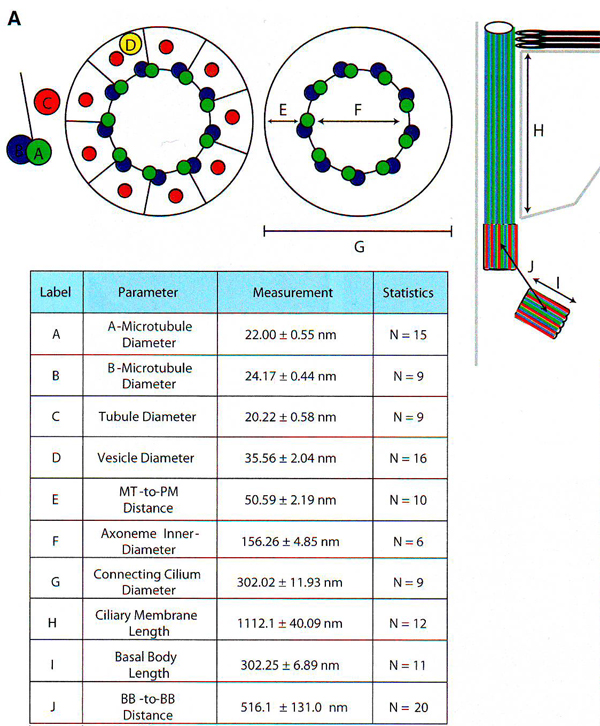
А и B . Измерение соединительной реснички (СС) (А) и наружного сегмента ( B ). Прямые измерения приведены в виде среднее ± стандартное отклонение. N – общее количество измерений, проведенных для каждого параметра.
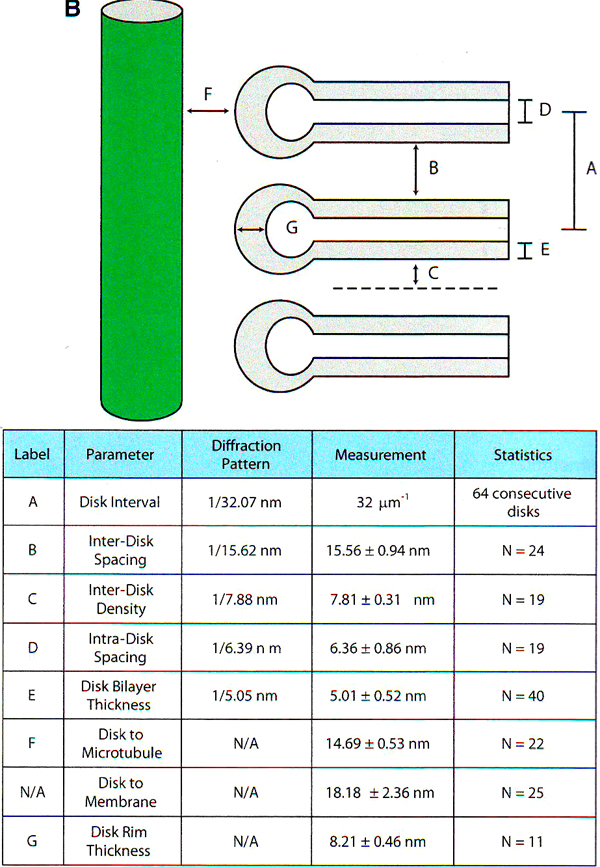
Рис. 7. Структурные нарушения, вызванные генетическими дефектами.

7А и 7 B Проекции томограммы ресничек дикого типа (А) и Crocc -/- ( B ).
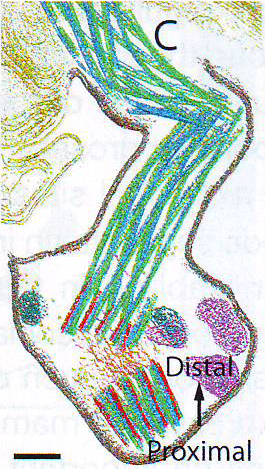
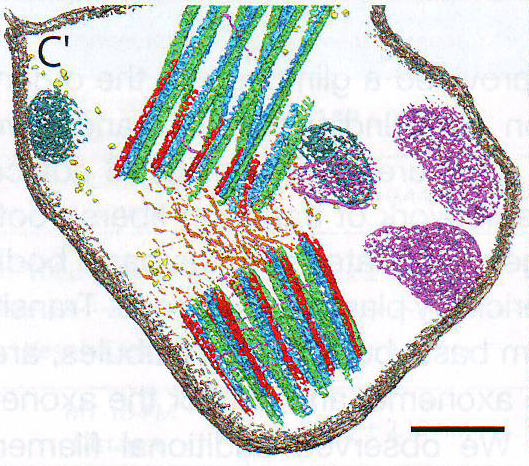
7C и 7C' Структурные различия в Crocc -/- ресничках приводят к хрупкости аксонем. Сегментация базальных телец и филаментов из рис. B . Микротрубочки (зеленые, синие, красные), взаимосвязывающиеся филаменты (оранжевые), плазматическая мембрана (серый), мембраны органелл (вероятно эндоплазматического ретикулума и митохондрий) (фиолетовый, синий), рибосомы (желтый) и разорванные диски наружного сегмента (желтый, левая сторона и правый верхний угол).
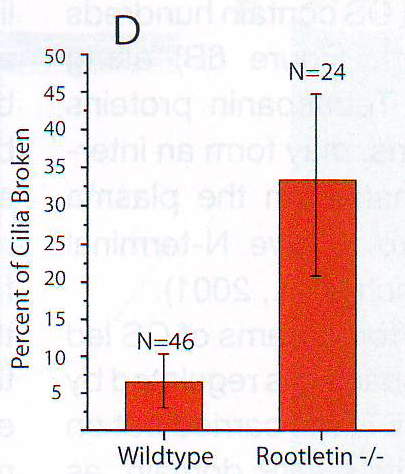
7D. Гистограмма сломанных аксонем на томограммах ресничек дикого типа и Crocc -/- . N – количество томограмм для каждого генотипа. Столбики ошибки представляют распределение Пуассона для N .

7E. Проекция (около 30 нм в толщину) ресничек дикого типа (вверху) и Crocc -/- (внизу).
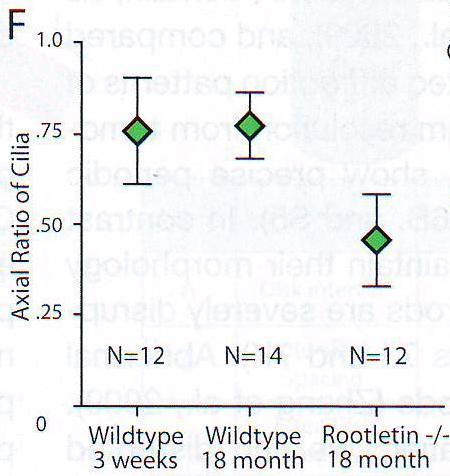
7F. Измененные аксиальные соотношения в Crocc -/- ресничках отражают структурные дефекты в мутантных аксонемах. N – количество аксонем, измеренное для каждого генотипа. Данные приведены в виде среднее ± стандартное отклонение.

7G. Томограмма наружного сегмента в Bbs 4 -/- палочке показывает нарушенную ориентацию диска и морфологию (стрелки).

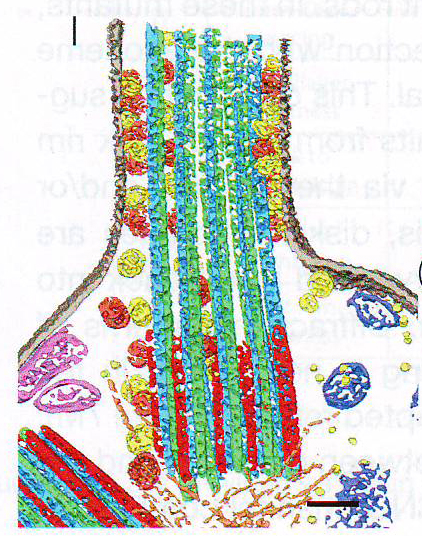
7H и 7I. Томограмма и сегментация Bbs 4 -/- соединительной реснички выявила накопление везикул вдоль аксонемы. Микротрубочки (зеленые, синие, красные), плазматическая мембрана (серый) и везикулы (желтые, розовые).
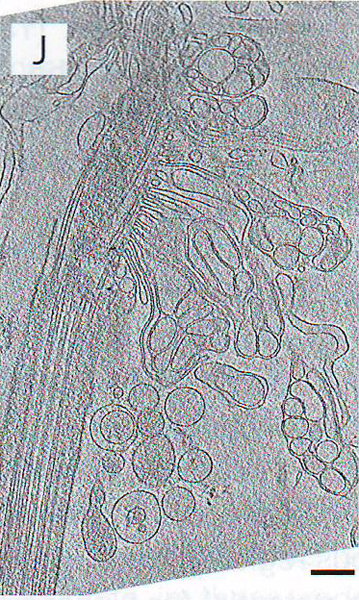
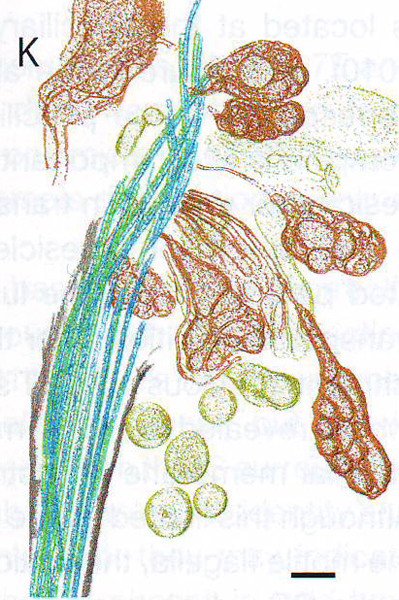
7J и 7K. Томограмма и сегментация Cngb 1 -/- палочки показывает разорванную структуру мембраны наружного сегмента вследствие аномального роста дисков наружного сегмента. Микротрубочки (зеленые, синие), плазматическая мембрана (серая) и диски наружных сегментов фоторецепторов (желтые, золотые).

7L. Проекция томограммы Cngb 1 -/- наружного сегмента показывает избыточный рост дисков вследствие нехватки контактов между плазматической мембраной (PM) и щелью между дисками. 7M . Трансформация Фурье из участка пунктирной линией на рис 7 L дает три максимума интенсивности, показывая нормальное расстояние между дисками в Cngb 1 -/- наружном сегменте.
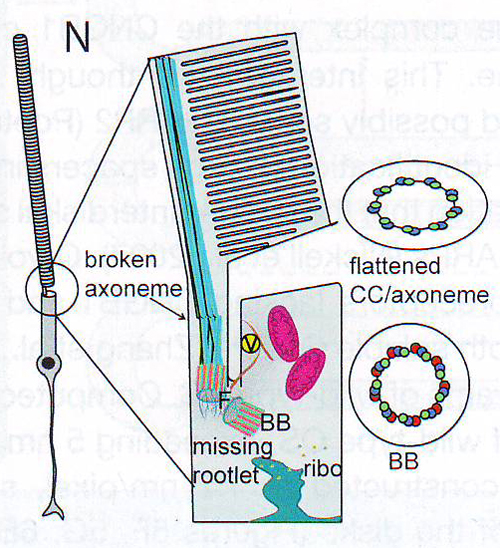
7N. Диаграмма нарушений, обнаруживаемых в Crocc -/- палочках.
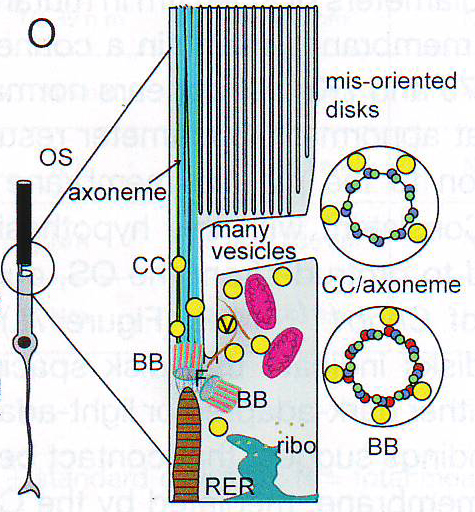
7O. Диаграмма нарушений, обнаруживаемых в Bbs 4 -/- палочках.
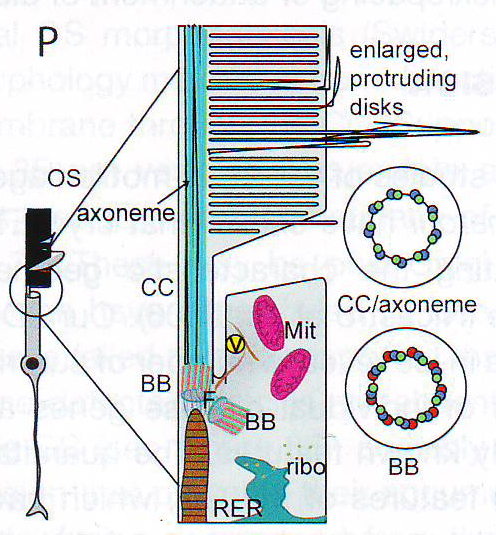
7P. Диаграмма нарушений, обнаруживаемых в Cngb 1 -/- палочках. Шкала : 7A-C', J, K, L 0,2 мкм . Е 0,1 мкм. G 0,4 мкм . H, I 50 нм.
Материал опубликован 3 марта 2013 г.
Марианной Ивановой (с)
www.ncbi.nlm.nih.gov/pubmed/23178122 |
|